¿ Cual es la precisión de los Test del COVID-19?
AUTOR: Dr. Carlos Rocha
Conceptos Clave
- El nuevo coronovarius (SARS-COV-2 o COVID-19) está causando una pandemia.
- EL virus es estable durante días en diferentes superficies y durante horas en aerosoles.
- Es importante el DIAGNÓSTICO de los ASINTOMÁTICOS.
- Se recomienda PERMANECER EN CASA para evitar la dispersión del virus especialmente provocado por personas asintomáticas.
- Las personas mayores y los varones parecen tener mayores tasas de positividad.
- La primera secuencia completa del genoma del SARS-CoV-2 fue cargada en el GenBank (número de acceso MN908947) por Zhang y colaboradores el 5 de Enero del 2020 posteriormente otras 19 secuencias genómicas han sido cargadas por otros investigadores.
- La PCR a tiempo real es el método más empleado actualmente para el diagnóstico. Sin embargo, es costosa, necesita equipos y personal específicos y tiene un porcentaje relativo de falsos negativos.
- Recientemente se ha comprobado la positividad del virus en heces lo que sugiere la posible transmisión oro-fecal.
- La tomografía computarizada de tórax ha demostrado en algunos estudios tener una sensibilidad del 98% y en otro del 88% (en 1014 pacientes) en caso de Covid-sospechosos aumentando al 97% en casos asociados a PCR positiva.
- La sensibilidad del test serológico rápido (Prueba de anticuerpos combinados IgG-IgM de COVID-19) es del 88,6% y la especificidad del 90,63% según algunas investigaciones.
- En un estudio recién publicado se encontró que la tasa de detección positiva aumenta significativamente (98,6%) cuando se combina el ensayo ELISA IgM con PCR en comparación con una sola prueba de qPCR (51,9%).
El nuevo coronavirus humano denominado actualmente coronavirus del síndrome respiratorio agudo severo 2 (SARS-CoV-2) anteriormente llamado H-CoVID-19, surgió en Wuhan, China, a fines de 2019 y ahora está causando una pandemia.1 El SARS-CoV-2 es un coronavirus perteneciente al grupo β-coronavirus y es la tercera enfermedad de coronavirus zoonótica conocida después del SARS-CoV y el Síndrome Respiratorio del Medio Oriente (MERS)-CoV. La evidencia actual respalda que el SARS-CoV-2 se derivó de los murciélagos, aunque los huéspedes intermedios del aún no se han determinado.2 Aunque en otros estudios se habla de un posible origen a través del pangolín.
Van Doremalen y cols 1 encontraron que la estabilidad en diferentes superficies del SARS-CoV-2 era similar a la de su predecesor el SARS-CoV-1, lo que nos indica que las diferencias epidemiológicas que observamos actualmente entre estos dos virus probablemente surgen de otros factores, incluidas las altas cargas virales en el tracto respiratorio superior e inferior y la posibilidad de que las personas infectadas con SARS-CoV-2 eliminen y transmitan el virus mientras están asintomáticos.3,4 Los autores 3,4 indican que la transmisión del SARS-CoV-2 en aerosoles y fómites es plausible, ya que demostraron que el virus podía permanecer viable e infeccioso en aerosoles durante horas y en superficies durante días. Por lo tanto, observamos la capacidad de este virus de permanecer en diferentes superficies y de ser transmitido por personas asintomáticas lo que nos obliga a PERMANECER EN CASA y lo que a su vez nos obliga como profesionales a buscar test diagnósticos fiables y a usar estos en el mayor número posible de personas, ya sean sintomáticas o asintomáticas. Sin embargo, estos esfuerzos están limitados por un problema difícil: ¿Cómo diferenciar los casos de COVID-19 de los sanos? Para los casos confirmados COVID-19 positivos, los síntomas clínicos comunes incluyen fiebre, tos, mialgia o fatiga.5 Sin embargo, estos síntomas no son características únicas de COVID-19 ya que son similares a los de otras enfermedades virales como el virus influenza.6
¿Qué tipos de test diagnósticos tenemos en la actualidad? ¿Cómo funcionan y en qué se diferencian?
Antes de comenzar, recordemos que la SENSIBILIDAD de un test es la capacidad de detectar enfermos y se define por:
Sensibilidad= Verdaderos positivos/ Verdaderos positivos + Falsos negativos
Que deriva en:
Sensibilidad= 1 – Falsos negativos
Y que la ESPECIFICIDAD de un test es la capacidad de detectar sanos y se define por:
Especificidad= Verdaderos Negativos/ Verdaderos negativos + Falsos positivos
Que deriva en:
Especificidad= 1 – Falsos positivos
Secuenciación del genoma:
La secuenciación del genoma completo es uno de los enfoques más completos para la identificación de los ácidos nucléicos virales de cualquier microorganismo. La primera secuencia completa del genoma del SARS-CoV-2 fue cargada en GenBank (número de acceso MN908947) por Zhang et al.7,8 el 5 de enero de 2020. Se identificaron cinco marcos de lectura abiertos (genes) típicos en el genoma del SARS-CoV-2: poliproteína ORF1ab (7096 aminoácidos), glucoproteína espiga (1273 aminoácidos), proteína de envoltura (75 aminoácidos), proteína de membrana (222 aminoácidos) y proteína de nucleocápside (419 aminoácidos). A partir del 6 de febrero de 2020, otros 19 investigadores de China,9,10 de los Estados Unidos y Australia cargaron en GenBank otras 19 secuencias genómicas de SARS-CoV-2 obtenidas mediante el uso de plataformas de secuenciación masiva o de nueva generación (NGS) Illumina o Nanopore. Como la secuenciación del genoma completo es relativamente costosa, requiere mucho tiempo y es complicada, no es adecuada para pruebas urgentes y a gran escala, siendo útil de cara a la investigación.8,11
Actualmente, el ácido nucleico del virus por PCR a tiempo real, la tomografía computarizada y algunos parámetros hematológicos son las herramientas principales para el diagnóstico clínico de la infección.
PCR a tiempo real:
La reacción en cadena de la polimerasa de transcripción inversa en tiempo real (RT-PCR) es el método de prueba más popular para la detección de SARS-CoV-2.6,8 En este método, el ARN del SARS-CoV-2 se transcribe primero de manera inversa en ADNc, y los fragmentos de genes específicos (los genes virales apuntados hasta ahora incluyen los genes N, E, S y RdRP) dentro del ADNc se amplifican usando cebadores específicos del objetivo a estudiar.8 La prueba de RT-PCR de ácido nucleico del virus se ha convertido en el método de diagnóstico estándar actual para el diagnóstico de COVID-19.12 Sin embargo, estos kits de prueba de PCR en tiempo real presentan muchas limitaciones: 1) Estas pruebas tienen tiempos de respuesta largos y su funcionamiento es complicado; generalmente toman en promedio más de 2 a 3 horas para generar resultados. 2) Las pruebas de PCR requieren laboratorios certificados, equipo costoso y técnicos capacitados para realizarlos.8 3) Hay un porcentaje considerable de falsos negativos para el COVID-19.6,8,13 De hecho, Yang y cols 14 demostraron que la tasa positiva total de RT-PCR para muestras de torunda de garganta era de aproximadamente 30% a 60% en la presentación inicial.
Estas limitaciones hacen sugerir que la RT-PCR no sea 100% adecuada para su uso en el campo diagnóstico y la detección rápida y simple de pacientes.
Por lo tanto, existía una necesidad urgente de una prueba rápida, fácil de usar, sensible y precisa para identificar rápidamente a los pacientes infectados de SARS-CoV-2 para prevenir la transmisión del virus y asegurar el tratamiento oportuno de los pacientes.
La reacción en cadena de la transcriptasa inversa-polimerasa en tiempo real (rRT-PCR) de los hisopos nasofaríngeos generalmente se ha utilizado para confirmar el diagnóstico clínico. Sin embargo, en otras formas que no sea por gotitas respiratorias, se desconoce. Recientemente en un trabajo realizado por Wang W y cols,15 usando Rt-PCR con valores de umbral de ciclo inferior a 37-40 como positivo para el ARN del SARS-CoV-2 demostraron que era posible detectar el SARS-CoV-2 en muestras de múltiples sitios de 205 pacientes con COVID-19, siendo las muestras del tracto respiratorio inferior con mayor frecuencia positivas para el virus. Es importante destacar de este trabajo que el virus funcional se detectó en las heces, lo que implica que el SARS-CoV-2 puede transmitirse por la ruta fecal. Además, los autores sugieren que la prueba realizada de múltiples muestras de múltiples sitios puede mejorar la sensibilidad y reducir los resultados estos tan temibles falsos negativos.15 Estos hallazgos son similares a los encontrados por Liu y cols16, donde únicamente 1875 de 4880 (38.42%) muestras fueron positivas mediante la prueba en RT-PCR de muestras respiratorias (nariz y faringe). Sin embargo, el líquido de lavado broncoalveolar exhibió la tasa positiva más alta (del 100%) para el gen ORF1ab de SARS-CoV-2 (n = 5), lo que sugiere que estas muestras podrían ser mejores para el diagnóstico. Interesantemente, esto autores encontraron mayores tasas de positivos en hombres y en ancianos. 16
En un estudio recién publicado por Chan y cols 17 parecen haber encontrado nuevos test de PCR-rt que leen diferentes secuencias génicas y parece aumentar la sensibilidad.
Tomografía Computarizada (TC) de tórax sin contraste:
La TC de tórax sin contraste puede considerarse para el diagnóstico precoz de la enfermedad viral, aunque la detección de ácido nucleico viral mediante la reacción en cadena de la polimerasa en tiempo real (RT-PCR) sigue siendo el estándar de referencia. Chung y cols.18 Informaron que la TC de tórax podía ser negativa para la neumonía viral por COVID-19 18 como presentación inicial en 3 de 21 pacientes. Por otro lado, recientemente, Xie y cols 19 informaron sobre 5/167 (3%) pacientes que tuvieron RT-PCR negativa para COVID-19 en la presentación inicial a pesar de los hallazgos en la TC de tórax típicos de la neumonía viral. A raíz de estas investigaciones, el grupo de Fang y cols 20 diseñaron un estudio con el propósito de comparar la sensibilidad del TC de tórax y la PCR a tiempo real en la presentación inicial del paciente.
En este estudio realizado en 51 pacientes encontraron que la sensibilidad de la TC de tórax fue mayor que la de RT-PCR (98% frente a 71%, respectivamente, p <.001). Las razones de la baja eficiencia de la detección de ácido nucleico viral según estos investigadores podrían incluir: 1) baja carga viral del paciente; 2) muestreo clínico incorrecto, 3) desarrollo inmaduro de la tecnología de detección de ácido nucleico; 4) variación en la tasa de detección de diferentes fabricantes. Según los autores, estos resultados respaldan el uso de la TC de tórax para la detección de COVD-19 en pacientes con características clínicas y epidemiológicas compatibles con la infección por COVID-19, particularmente cuando las pruebas de RT-PCR son negativas. En general, el problema principal de la PCR parece ser que frotando el hisopo por la faringe se recoge una cantidad mínima de ARN viral, que además luego hay que extraer del algodón, es decir muchas veces no se recoge nada o es insuficiente para procesarlo, e inclusive si se recogiera poca cantidad, esta luego puede llegar a perderse en el proceso de extracción.
En otro estudio, este llevado a cabo por Tao y cols, 21 los autores reafirmaron esta teoría al encontrar que:
Las tasas positivas de RT-PCR y TC de tórax en una cohorte fueron del 59% (601/1014) y del 88% (888/1014) para el diagnóstico de pacientes sospechosos y con COVID-19, respectivamente.
2. Con los resultados de RT-PCR como referencia en 1014 pacientes, la sensibilidad, especificidad y precisión de la TC de tórax para determinar la infección por COVID-19 fueron 97% (580/601), 25% (105/413) y 68% (685/1014), respectivamente. El valor predictivo positivo y el valor predictivo negativo fueron 65% (580/888) y 83% (105/126), respectivamente.
3. Con el análisis de los resultados de RT-PCR en serie y las TC, del 60% al 93% de los pacientes tuvieron una TC torácica positiva inicial consistente con COVID-19 antes de los resultados iniciales positivos de RT-PCR. El 42% de los pacientes mostraron una mejoría tomográfica durante el seguimiento antes de que los resultados de RT-PCR se volvieran negativos.
Casi todos los pacientes con COVID-19 tienen unas características en la TC específicas: Diferentes grados de opacidad en vidrio esmerilado, neumonía organizada multifocal y distorsión arquitectónica periférica. 21
Por lo que de acuerdo a estos autores es de suponer que en pacientes con pruebas de RT-PCR negativas, se debería utilizar la combinación de posibles antecedentes de exposición, síntomas clínicos, características típicas de imágenes de CT y cambios dinámicos para identificar COVID-19 con una mayor sensibilidad.
Ejemplos de hallazgos típicos en TC de tórax compatibles con neumonía por COVID-19 en pacientes con presentación epidemiológica y clínica sospechosos de infección por COVID-19. A, hombre, 74 años con fiebre y tos durante 5 días. La tomografía axial computarizada de tórax muestra opacidades bilaterales en vidrio esmerilado. B, mujer, 55 años, con fiebre y tos durante 7 días. La tomografía computarizada de tórax axial muestra extensas opacidades y consolidación en vidrio esmerilado bilateral. Fuente: Fang Y, Zhang H, Xie J, Lin M, Ying L, Pang P, Ji W. el al. Sensitivity of Chest CT for COVID-19: Comparison to RT-PCR.Radiology. 2020 Feb 19:200432. doi: 10.1148/radiol.2020200432.
Está ampliamente aceptado que la inmunoglobulina (Ig) IgM proporciona la primera línea de defensa durante las infecciones virales, antes de la generación de respuestas de IgG adaptativas de alta afinidad que son importantes para la inmunidad a largo plazo y para la memoria inmunológica.6 Se ha observado que después de la infección por SARS, el anticuerpo IgM podría detectarse en la sangre del paciente después de 3 a 6 días e IgG podría detectarse después de 8 días. 22 Dado que el COVID-19 pertenece a la misma gran familia de virus que los que cauron el brote de MERS y SARS, se puede asumir que su proceso de generación de anticuerpos es similar, y que la detección de anticuerpos IgG e IgM contra el SARS-CoV-2 será una indicación de infección (que no discrimina si es activa o pasada).6 Además, la detección de anticuerpos IgM tiende a indicar una exposición reciente al SARS-CoV-2, mientras que la detección de anticuerpos IgG COVID-19 indica la exposición al virus hace algún tiempo. Y en esta premisa se basan las pruebas serológicas que pasamos a explicar:
Pruebas serológicas: 23
Las pruebas basadas en serología analizan el componente sérico (suero) de la sangre. El suero incluye anticuerpos contra componentes específicos de los patógenos, los llamados antígenos. Estos antígenos son reconocidos por el sistema inmune como extraños y están dirigidos por la respuesta inmune. Este tipo de prueba a menudo se usa en infecciones virales para ver si el paciente tiene una respuesta inmune a un patógeno de interés, como en este caso podría ser el coronavirus.
Existen varios tipos de pruebas de serología. 23
1. Pruebas de neutralización: que pueden indicar si el paciente tiene
anticuerpos activos y funcionales contra el patógeno en cuestión midiendo cuánto pueden inhibir los anticuerpos del paciente el crecimiento viral en el laboratorio.
2. Inmunofluorescencia: que muestra si un paciente tiene anticuerpos contra un patógeno al mostrar una señal fluorescente cuando los anticuerpos del paciente interactúan con las proteínas del virus.
3. ELISA por sus siglas en inglés«Enzyme-Linked ImmunoSorbent Assay´´ o en español «ensayo por inmunoabsorción ligado a enzimas´´:
son pruebas de serología más rápidas que proporcionan una lectura de las interacciones antígeno-anticuerpo. Esencialmente, los anticuerpos del paciente están «intercalados» entre la proteína viral de interés y los anticuerpos informadores, de modo que se detecte cualquier anticuerpo activo del paciente.
4. Pruebas de Western blot, que pueden usarse en entornos de laboratorio para detectar la presencia de una proteína de interés mediante la emisión de un indicador coloreado o fluorescente cuando un anticuerpo activo interactúa con la proteína viral.
5-Inmunocromatografía (TEST RÁPIDO): que se basa en la migración de una muestra a través de una membrana de nitrocelulosa. La muestra es añadida en la zona del conjugado, el cual está formado por un anticuerpo específico contra uno de los epítopos del antígeno a detectar y un reactivo de detección. Si la muestra contiene el antígeno problema, éste se unirá al conjugado formando un complejo inmune y migrará a través de la membrana de nitrocelulosa. Si no, migrarán el conjugado y la muestra sin unirse.
En base a esto Li y cols, 6 desarrollaron un producto de prueba de inmunoensayo de flujo lateral (por sus siglas en inglés, LFIA), un tipo de inmunocromatografía, que puede detectar IgM e IgG simultáneamente en sangre humana en 15 minutos. Probaron el producto en 8 hospitales y agencias chinas de CDC para validar su eficacia clínica. Los resultados demostraron que esta prueba rápida de anticuerpos tiene una alta sensibilidad y especificidad. Es un inmunocromatogragía (tipo LFIA) para la determinación rápida de la presencia o ausencia de anti-SARS-CoV-2-IgM y anti-SARS-CoV-2-IgG en muestras humanas (sangre total, suero y plasma). La prueba consiste en colocar la sangre del paciente en una tira serológica que contiene proteínas recombinantes (sintéticas) del COVID-19 y anticuerpos anti región FC (cola del anticuerpo) IgM o IgG igualmente denominados anticuerpos anti IgM o IgG. Si hubiera anticuerpos anti-COVID-19 se unirán a la proteína recombiante los anticuerpo anti IgM o IgG que llevan acoplados un colorante dando una reacción y cambiando de color (se vuele rojo/púrpura). 6
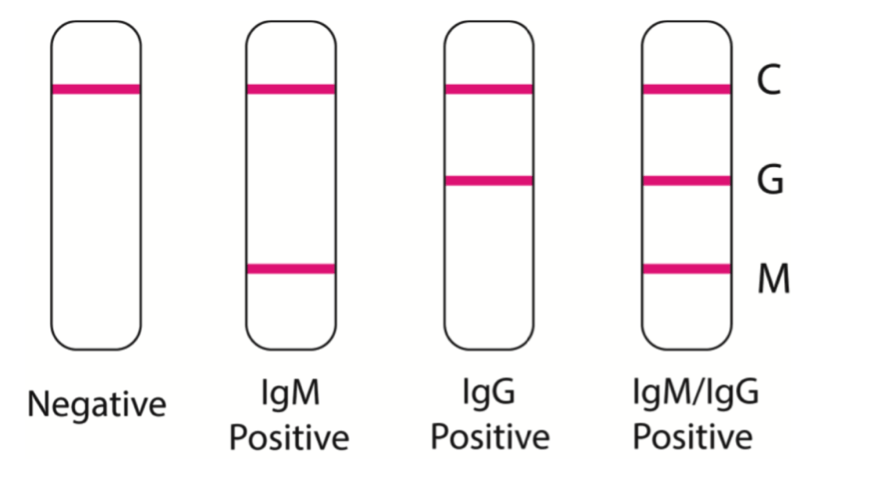
Específicamente el mecanismo se basa en la hidratación y el transporte de reactivos a medida que interactúan con la muestra a través de la tira y a través del flujo lateral cromatográfico. A medida que la muestra fluye por del dispositivo, los anticuerpos anti-SARS-CoV-2 IgG e IgM, si estuvieran presentes en la muestra, se uniría por el reactivo colorimétrico dorado marcado con antígeno SARS-CoV-2 fijado en la almohadilla conjugada. A medida que la muestra conjugada continúa viajando por la tira, los anticuerpos anti-SARS-CoV-2 IgM se unen en la línea M (IgM), y los anticuerpos anti-COVID-19 IgG se unen a la línea G (IgG). Si la muestra no contiene anticuerpos contra el SARS-CoV-2, no se unen complejos marcados en la zona de prueba y no se pueden observaran líneas (Figura).
Este grupo 6 evaluó un total de 525 casos: 397 pacientes (positivos) confirmados clínicamente (incluida la prueba de PCR) con SARS-CoV-2 y 128 pacientes no infectados (negativos). De las 397 muestras de sangre de pacientes infectados con SARS-CoV-2, 352 dieron positivo, lo que resultó en una sensibilidad del 88,66%. 12 de las muestras de sangre de los 128 pacientes con infección sin SARS-CoV-2 dieron positivo, generando una especificidad del 90,63%. Igualmente encontraron que la sensibilidad de detección fue mayor en la prueba de anticuerpos combinados IgG-IgM que en la prueba individual de anticuerpos IgG o IgM.
En comparación con la RT-PCR, los autores encontraron que esta prueba ahorraba tiempo y no requería un equipo específico ni complejo, era simple de realizar y solo requería un entrenamiento mínimo. Se puede realizar junto a la cama, en cualquier clínica o laboratorio, en aeropuertos o estaciones de ferrocarril. Otra aplicación potencial de esta prueba es la detección de portadores asintomáticos de SARS-CoV-2. Como limitación del estudio, no estudiaron la posible reactividad cruzada con otros coronavirus y con el virus de la gripe y además el nivel de cambio del anticuerpo no se comparó en las diferentes etapas de la infección por SARS-CoV-2 por lo que esto puede suponer ciertos errores diagnósticos, dependiendo de la etapa en la que se diagnostique. Li y cols 6 sugieren que la combinación de RT-PCR del ARN y la prueba de anticuerpos IgM-IgG puede proporcionar un diagnóstico de infección por SARS-CoV-2 más preciso.
Development and Clinical Application of A Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. J Med Virol 2020 Feb 27
Solo hace 2 semanas, Guo y cols, 24 publicaron un estudio en el que encontraron que la mediana del tiempo en la detección de anticuerpos IgM e IgA del COVID-19 usando ELISA (recordemos que es otra de las pruebas serológicas), fue de 5 días, mientras que la de IgG fue de 14 días tras el inicio de los síntomas, con una tasa positiva de 85.4%, 92.7% y 77.9% respectivamente. En casos confirmados y probables, las tasas positivas de anticuerpos IgM fueron de 75.6% y 93.1%, respectivamente. La eficacia de detección por ELISA de IgM encontraron que era mayor que la del método PCR después de 5,5 días de inicio de síntomas. La tasa de detección positiva aumentó en su estudio significativamente (98,6%) cuando combinaron el ensayo ELISA IgM con PCR para cada paciente en comparación con una sola prueba de qPCR (51,9%). 24
Los autores sugieren que la respuesta humoral al SARS-CoV-2 puede ayudar al diagnóstico de COVID-19, incluidos en los tan importantes casos subclínicos, por lo que proponen realizar las pruebas de anticuerpos cuando la prueba PCR sea negativa y existan otros signos de sospecha de COVID-19, incluidos los síntomas típicos y posibles contacto de riesgo. 24
Un diagnóstico falso negativo puede tener graves consecuencias, especialmente en esta etapa de la pandemia al permitir que los pacientes infectados propaguen la infección y obstaculicen los esfuerzos para contener la propagación del virus. 24
Las características clínicas, las imágenes de tórax y las pruebas de etiología basadas en genes virales RT-PCR e inmunología (pruebas rápidas y de ELISA) deberían combinarse para tener una mayor certeza de confirmar tantos los verdaderos positivos como los verdaderos negativos.16 La RT-PCR en tiempo real sigue siendo el método de detección más utilizado en grandes hospitales, sin embargo, las nuevas técnicas de inmuno-ensayo basadas en anticuerpos, los sensores biomoleculares basados en papel y los recientes y prometedores métodos basados en el sistema CRISPR-Cas para detectar los ácidos nucleicos virales (p. Ej., el método SHERLOCK que permite detectar concentraciones atomolares de ADN y ARN, que además ya ha sido usado para amplificar los fragmentos ARN diana del virus Zika o del virus Dengue y que teóricamente podría usarse para el COVID-19) se siguen desarrollando y se espera que puedan llegar a consolidarse como métodos de detección a gran escala que incluso puedan llegar a usarse en el hogar.
Agradecimiento:
El autor de esta revisión quiere expresar su agradecimiento a su amigo el Dr Marcos Torchia Esteban, Médico Interno Residente en Inmunología del Hospital Universitario 12 de Octubre (Madrid, España) por toda la ayuda y consejos a la hora de realizar esta revisión.
Bibliografía:
1-van Doremalen N, Bushmaker T, Morris DH, Holbrook MG, Gamble A, Williamson BN et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. N Engl J Med. 2020 Mar 17. doi: 10.1056/NEJMc2004973.
2-Sun P, Lu X, Xu C, Sun W, Pan B. Understanding of COVID-19 based on current evidence. J Med Virol 2020 Feb 25. DOI: 10.1002/jmv.25722
3-Bai Y, Yao L, Wei T, et al. Presumed asymptomatic carrier transmission of COVID-19. JAMA 2020 February 21 (Epub ahead of print).
4-Zou L, Ruan F, Huang M, et al. SARS-CoV-2 viral load in up- per respiratory specimens of infected patients. N Engl J Med. DOI: 10.1056/NEJMc2001737.
5-Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020.
6-Li Z, Yongxiang Yi, Xiaomei Luo, Nian Xiong , Yang Liu , Shaoqiang Li
Development and Clinical Application of A Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. J Med Virol 2020 Feb 27
7-Zhang et al., Probable Pangolin Origin of SARS-CoV-2 Associated with the COVID-19 Outbreak, Current Biology (2020), https://doi.org/10.1016/j.cub.2020.03.022
8-Liu R, Fu A, Deng Z, Li Y, Liu T. Promising methods for detection of novel coronavirus SARS-CoV-2. DOI: 10.1002/viw2.4
9-Chan J-W, Yuan S, Kok K-H, To K k-W, Chu H, Yan J et al.Familial Cluster of Pneumonia Associated With the 2019 Novel Coronavirus Indicating Person-To-Person Transmission: A Study of a Family Cluster. Lancet,2020; (10223), 514-523
10-Chen L, Liu W, Zhang Q, Xu K, Ye G, Wu W Sun Z et al. RNA Based mNGS Approach Identifies a Novel Human Coronavirus From Two Individual Pneumonia Cases in 2019 Wuhan Outbreak. Emerg Microbes Infect 2020; 9 (1), 313-319
11-Johns Hopkins Center for health security. Diagnostic Testing for 2019-nCoV. January 28, 2020.
12-Jin YH, Cai L, Cheng ZS, et al. A rapid advice guideline for the diagnosis and treatment of 2019 novel coronavirus (COVID-19) infected pneumonia (standard version). Mil Med Res. 2020;7(1):4.
13-Gallagher J. Are Coronavirus Tests Flawed? BBC News wwwbbccom/news/health-51491763. 13 Feb. 2020.
14- Yang Y, Yang M, Shen C, et al. Evaluating the accuracy of different respiratory specimens in the laboratory diagnosis and monitoring the viral shedding of 2019-nCoV infections. 2020. DOI:http://doi.org/10.1101/2020.02.11.20021493.
15- Wang W, Xu Y, Gao R, Lu R, Han K, Wu G et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA 2020. DOI: 10.1001/jama.2020.3786
16-Liu R, Han H, Liu F, et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020 [published online ahead of print, 2020 Mar 7]. Clin Chim Acta. 2020;505:172–175. doi:10.1016/j.cca.2020.03.009
17-Chan JF, Yip CC, To KK, et al. Improved molecular diagnosis of COVID-19 by the novel, highly sensitive and specific COVID-19-RdRp/Hel real-time reverse transcription-polymerase chain reaction assay validated in vitro and with clinical specimens [published online ahead of print, 2020 Mar 4]. J Clin Microbiol. 2020;JCM.00310-20. doi:10.1128/JCM.00310-20
18-Chung M, Bernheim A, Mei X, et al. CT Imaging Features of 2019 Novel Coronavirus (2019-nCoV). Radiology, undefined(undefined), 200230. doi:10.1148/radiol.2020200230.
19-Xie, X, Zhong, Z, Zhao, W, Zheng, C, Wang, F, Liu, J. Chest CT for typical 2019-nCoV pneumonia: relationship to negative RT-PCR testing. Radiology 2020. https://doi.org/10.1148/radiol.2020200343. Published online Feb 12, 2020.
20-Fang Y, Zhang H, Xie J, Lin M, Ying L, Pang P, Ji W. el al. Sensitivity of Chest CT for COVID-19: Comparison to RT-PCR.Radiology. 2020 Feb 19:200432. doi: 10.1148/radiol.2020200432.
21-Tai A, Yang Z, Hou H, Zhan C, Chen C, Tao Q et al. Correlation of Chest CT and RT-PCR Testing in Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases. Radiology 200642. DOI: 10.1148/radiol.2020200642
22-Lee HK, Lee BH, Seok SH, et al. Production of specific antibodies against SARS- coronavirus nucleocapsid protein without cross reactivity with human coronaviruses 229E and OC43. J Vet Sci. 2010;11(2):165-167.
23-Johns Hopkins Center for health security. Serology testing for COVID-19. February 28, 2020.
24-Guo L, Ren L, Yang S, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin Infect Dis. 2020; ciaa310. doi:10.1093/cid/ciaa310